 |
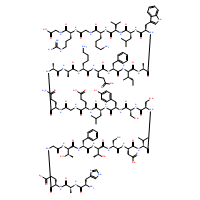
人胰高血糖素样肽-1Human GLP-1 (7-37) |
|||
| 产品编号: | P0143239 | CAS号: | ||
| 分子式: | C151H228N40O47 | 分子量: | 3355.67 | |
| EIENCS: | ||||
人胰高血糖素样肽-1项目简介
一、概述
随着对糖尿病基础理论研究的深入,人们发现目前的药理研究和治疗方法尚不能涵盖该疾病所涉及的所有代谢性缺陷。保护胰岛β细胞功能和积极控制血糖的重要性越来越得到广大医家的重视,现有的治疗方法存在不同的缺陷和弊端,新的药物作用靶点正在不断开发。
正常人口服葡萄糖引起的胰岛素分泌反应要远远强于静脉注射者,这种口服葡萄糖后引起胰岛素分泌增加的效应主要是由胃肠内分泌细胞产生的肽类物质的作用,这些肽类物质称为肠促胰岛素[1,2]。“胃肠-胰岛轴”(enteroinsular axis)的概念应运而生,提示着这些胰岛素促泌素是在摄取营养物质后肠的内分泌系统合成和释放的。胰高血糖素样肽-1(glucagon-like peptide 1,GLP-1)是一种肠促胰岛素,近年来成为糖尿病治疗领域的研究热点,受到广泛关注。
1.1 胰高血糖素样肽-1的结构和代谢
GLP-1来源于胰高血糖素原(proglucagon,PG),后者包含有两种胰高血糖素样肽,即GLP-1和GLP-2[3]。胰高血糖素原分子中含有160个氨基酸[4],哺乳动物的胰高血糖素原基因转录的胰高血糖素原RNA在脑、胰腺和肠内的翻译过程各自不同[5]。胰高血糖素原分子在肠和胰腺中被不同的酶加工成作用不同的激素,胰腺中主要的胰高血糖素原片段占71%,GLP-1(1-36)NH2占24%,GLP-1(1-37)NH2占5%,而在肠中GLP-1(1-36)NH2占80%,GLP-1(1-37)NH2占20%[4]。尽管在胰岛细胞控制胰高血糖素原基因表达的因素方面已经取得一些进展[6,7],但是在肠的内分泌细胞生物合成GLP-1的控制方面还了解不多,肠内特定的胰高血糖素原基因增强子、胰高血糖素原启动子转录因子大部分还不明确。
GLP-1主要由末端空肠、回肠和结肠的Langerhans细胞分泌,是胰高血糖素原基因翻译后的加工产物,酶解去掉N端的6肽和C端酰胺化后即生成的,包括GLP-1(7-37)NH2和GLP-1(7-36)NH2[8]两种形式。GLP-1(7-36)NH2是人体内的GLP-1的自然存在形式,促进胰岛素分泌作用在GLP-1肽中最强。
GLP-1受体(GLP-1R)是一个与G蛋白、偶联的7个跨膜结构,以cAMP为主要第二信使。它属于G蛋白偶联受体B家族(分泌素家族)中的胰高血糖素受体亚家族,该家族最明显的特征是相对较长的胞外N端序列,通过3个二硫键形成一个球状结构域[9]。人GLP-1受体与鼠受体有90%的同源性,其基因位于6P[10],基mRNA转录子已经在啮齿动物的胰腺、肺、肾、胃和脑组织中检测到[11]。解剖学的证据表明:鼠、猪和人肠道各段都可见GLP-1R细胞,不同种属间分布密度不同,分布规律相同,即从小肠和大肠的近端向远端细胞逐渐增大[12,13]。
GLP-1在体内的表达和活性受到严密的调控,当N端第二位丙氨酸被二肽基肽酶(dipeptidy1 protease Ⅳ,DPP-Ⅳ)水解后,形成无活性的GLP-1(9-36)NH2,成为GLP-1R的体内天然拮抗剂[14]。GLP-1在体内的半衰期不足5min,其新陈代谢的速率为12~13min。在生理状态下,完整的GLP-1主要是通过肾脏的排泄,由肾外组织协助排除[15]。
;
1.2 胰高血糖素样肽—1的生理效应
GLP-1能够促进胰岛素分泌,在分离的Langerhans细胞、动物和人体实验均证实这一点,且这种促进作用是葡萄糖依赖性的,血糖越高作用越强[16]。其促进胰岛素分泌的机制与腺苷酸环化酶(adenylate cyclase)激活和磷脂酶C(phospholipase C)途径有关,也与升高胰岛细胞内Ca2+浓度有关[17~19]。GLP-1与胰岛β细胞细胞膜上的受体结合,通过增加细胞内cAMP,使K+-ATP酶磷酸化,导致K+通道关闭,细胞膜去极化,Ca2+通道开放,Ca2+内流,刺激胰岛素从细胞排出,从而促进胰岛素分泌。同时,这种作用又是全方位的,影响前胰岛素基因的转录、翻译及剪切等各个功能环节[20,21]。此外,GLP-1也能够上调β细胞中与糖代谢密切相关的基因(如葡萄糖激酶和葡萄糖转运蛋白-2),但胰岛素基因启动子可以部分不依赖PKA的方式被激活[22]。
GLP-1也能够刺激胰岛β细胞增生,抑制其凋亡。研究发现GLP-1在no-STZ model大鼠能刺激β细胞新生,改善成年大鼠血糖的自身稳定[23]。在新生GK大鼠中,经GLP-1或Exendin-4注射5日,血糖恒定状态显著改善,胰岛素水平升高,β细胞实体增大。继续应用上述药物,大鼠β细胞持续增加,成年时血糖控制能力显著提高[24]。体外细胞培养发现,GLP-1能诱导小鼠成肌细胞株和胚胎干细胞分化为胰岛素表达细胞[25,26]。在Zucker糖尿病大鼠模型中,β细胞凋亡的比例最高达20%以上,GLP-1的治疗能使凋亡细胞比例显著下降。以链脲佐菌素(streptozocin,STZ)诱导小鼠β细胞凋亡,研究发现GLP-1能抑制其凋亡,而GLP-1R基因敲除小鼠的β细胞对STZ诱导凋亡的敏感性显著升高。
GLP-1能抑制胰高血糖素的释放。在血糖调节中,胰升糖素的作用和胰岛素相反,通过促进肝糖原分解增加血糖的浓度。在健康人、1型糖尿病和2型糖尿病患者中均证实,GLP-1能抑制胰升糖素的释放,其中在健康人体中其作用程度小于糖尿病患者。给C肽阴性的狗注射GLP-1能降低血浆胰升糖素水平,提示GLP-1抑制胰升糖素的作用至少部分是不依赖于胰岛素的[27]。
在对鼠、猪和人的一系列研究中发现,GLP-1可抑制胃肠道蠕动和胃液分泌,延迟胃排空。在血糖控制较差的2型糖尿病患者中,自餐前30min至进液体食物后240min期间持续静脉注射GLP-1,胃容量始终停留在最初的400ml,而安慰剂组病人胃容量在120min内缩小为(58±19)ml(P<0.0001)[28]。GLP-1抑制胃排空可以部分解释其降血糖的作用,从理论上讲,胃排空的抑制可以减缓那些只能在小肠吸收的营养物质进入体内,类似于α糖苷酶抑制剂。
GLP-1在神经组织也有影响。GLP免疫反应广泛分布在脑的许多地带,GLP-1R在下丘脑、脑干及小脑中均有表达[29]。在离体实验中,GLP-1可促进神经元细胞的分化,其功能类似神经生长因子,但相关的信号通道仍待了解。在人体,无论是正常人还是糖尿病患者,应用GLP-1均可使其产生短暂的饱胀感觉和食欲下降。丘脑与饮食控制有关,该区域又有GLP-1R表达,推测外周的GLP-1可能通过信号传递间接影响中枢神经而产生饱胀感觉,减少食欲。
GLP-1的结构及生理功能
血糖依赖性促胰岛素分泌作用
Egan给予10例2型糖尿病患者 (空腹血糖11.4±0.9mmol/L) 皮下注射exenatide一日1~2次,1个月后患者平均睡前血糖从15.5mmol/L下降至9.2mmol/L(P<0.0001),平均HbA1c从9.1%下降至8.3%( P<0.0001)。Kolterman等对2型糖尿病患者进行了随机交叉对照临床研究以观察exenatide的临床疗效和安全性。A组为单盲安慰剂与exenatide交叉研究,24例2型糖尿病患者皮下注射exenatide,每次0.1mg/kg,一日2次,共5天,洗脱期2~3天,然后予相同剂量安慰剂5天。B组为双盲安慰剂的四阶段交叉研究,13例2型糖尿病患者随机分别隔日皮下注射exenatide 0.05、0.1和0.2mg/kg或安慰剂,间歇日为洗脱期。结果显示,exenatide注射后,空腹及餐后血糖均显著下降,降糖作用与血糖水平有关。当血糖高于正常时,其促进β细胞释放胰岛素,当血糖低于正常时,exenatide不再显示进一步降糖作用。由此可见,exenatide优于目前所用的磺酰脲类降糖药,后者的促胰岛素释放作用并非血糖依赖性,故临床上易发生低血糖反应。在随机双盲安慰剂对照II期临床研究中,109例用磺酰脲类降糖药和二甲双胍治疗而HbA1c仍大于8%的2型糖尿病患者随机分为2组,一组注射exenatide(每次0.08mg/kg,一日2~3次),另一组给予安慰剂。4周后,exenatide组餐后血糖较安慰剂组下降显著(3.2~4.4 mmol/L对0.6 mmol/L,P≤0.004),空腹血糖也趋下降,但组间无显著差异。果糖胺平均下降39~46mmol/L(P≤ 0.004),HbA1c下降0.7%~1.1% (P≤0.006)。研究结束时,HbA1c<7%者exenatide治疗组达15%,而安慰剂组仅为4%。可见exenatide应用4周,已显示较为满意的HbA1c降低作用。
重建胰岛素/胰高血糖素比值
众所周知,门静脉胰高血糖素水平升高,尤其是胰岛素/胰高血糖素比值下降,可导致肝糖输出增加和高血糖。目前临床所用降糖药(包括胰岛素)不能抑制糖尿病患者餐后胰高血糖素的升高。在上述研究中,患者注射exenatide后空腹及餐后胰高血糖素水平均下降。由此可见,exenatide通过促进胰岛素的释放,抑制胰高血糖素分泌,重建了更符合生理的胰岛素/胰高血糖素比值,故在2型糖尿病治疗中具有重要意义。
增加β细胞数量
大量的体外试验已证实,exenatide可促进β细胞增殖或胚胎胰岛成熟分化以及抑制β细胞凋亡。Fineman观察了2型糖尿病患者接受exenatide治疗后β细胞数量的变化,经稳态模型(HOMA)评估β细胞指数提示,在研究的第14和28天,β细胞指数分别高于基线的50%和100%,而安慰剂组β细胞指数无变化。此外,exenatide治疗后,经HOMA测算的胰岛素分泌能力可增加50% (0.56 ±0.16对0.36 ±0.12,P<0.001)。上述研究验证了exenatide对β细胞的保护作用。
延迟胃排空
GLP-1除通过促进胰岛素分泌和增加胰岛β细胞数量发挥抗糖尿病作用外,对胃肠动力亦有作用。有研究用3-O-甲基葡萄糖水平间接反映胃排空时间,经GLP-1类似物治疗后,3-O-甲基葡萄糖AUC明显下降[400±84对440±70(mg•h)/L,P=0.02]。提示exenatide治疗可明显延迟胃排空,从而有利于餐后血糖的控制。
安全性
临床研究显示,exenatide耐受性较好,主要不良反应为短时间轻度头痛、恶心和呕吐。Fineman等的研究中,治疗初期30%患者有恶心症状,28天后降至13%,但15%患者出现低血糖,可能与这些患者同时联用磺酰脲类药物有关。晚近,有报道预先给于小剂量exenatide (每次0.02mg/kg,一日3次) 35天后,再予大剂量(每次0.24mg/kg,一日3次)exenatide治疗,消化道反应明显减少。如何减轻exenatide的胃肠道反应及免疫反应,仍是药物研发的课题。
1.3 胰高血糖素样肽—1的临床应用
随着对GLP-1及其与糖尿病的相关性研究的不断深入,国内外医药研发机构越来越重视这一领域,目前开发重点在抵抗DPP-Ⅳ水解的GLP-1类似物。丹麦Novo Nordisk开发了白蛋白结合的GLP-1类似物(liraglutide),半衰期达10h,已进入3期临床。美国Amylin医药公司开发了GLP-1类似物(Exendin-4),可抵抗DPP-Ⅳ水解,也已进入3期临床[30]。法国Aventis公司和丹麦Zealand公司近期又宣布合作研究Exendin-4的另一衍生物——ZP10。另外,DPP-Ⅳ抑制剂和GLP-1R非肽类小分子激动剂也是两个研究的方向。
GLP-1类似物
如前所述,哺乳动物天然GLP-1 t1/2极短,限制了其临床应用,因此,有必要开发能满足临床应用的GLP-1类似物,目前多家制药公司正在开发合成GLP-1类似物。
exendin-4
此系从蜥蜴唾液腺分离的天然GLP-1类似物,含有39个氨基酸,与哺乳动物GLP-1的氨基酸序列53%同源,与GLP-1受体具有高度亲和性,并具有相似的生物学作用。exendin-4的N端不被DPP-IV分解,故血浆t1/2更长,具有良好的临床应用前景。合成exendin-4被命名为exenatide,目前已完成III期临床研究,并进入注册前阶段。此外,Amylin和Alkermes公司正在合作研发一种exenatide缓释制剂(exenatide LAR),仅需一月给药1次,可明显提高临床依从性。
liraglutide (NN2211)
本品为GLP-1酰化衍生物,能与白蛋白结合,代谢稳定,由注射部位缓慢释放,作用时间延长。Juhl等进行了初步随机双盲安慰剂对照临床研究,纳入研究的11例2型糖尿病患者(HbA1c 6.5%±0.6%),晚间23时给予皮下注射本品(10mg/kg)或安慰剂,12小时后提供标准餐。与安慰剂组相比,本品组空腹血糖明显下降(6.9±1.0对8.1±1.0mmol/L,P=0.004),胰岛素分泌率增加 (179±70对163±66pmol/min,P= 0.03),胰高血糖素无明显变化(P= 0.17)。餐后血糖曲线下面积(AUC)显著下降[30.6±2.4对39.9±7.3(mmol•h)/L,P<0.001],胰高血糖素AUC明显减少[77±18对82±17(pmol•h)/L,P=0.04]。追踪本品血药浓度63小时可见,t1/2为10.0±3.5小时,Tmax为12.4±1.7小时。2例患者在治疗中分别出现轻至中度恶心症状。上述结果提示,本品通过增加胰岛素释放,抑制胰高血糖素分泌及延缓胃排空,明显降低空腹及餐后血糖,具有较好的耐受性,一日1次睡前用药,具有一定的临床应用前景 (本品由诺和诺德公司开发,目前处于II期临床研究)。
其他GLP-1制剂
其他长效GLP-1制剂如Albugon和CJC-1131通过与白蛋白结合,对抗DPP-IV降解。Albugon在猴体内的t1/2达3天,并能24小时维持糖尿病大鼠的血糖接近正常水平。CJC-1131在鼠体内的t1/2为18小时。两者的安全性及有效性均需进一步的临床研究证实。
exenatide在2型糖尿病中的应用
exenatide由美国Amylin公司开发,是目前唯一完成新药注册前临床研究的GLP-1类似物,可作用于2型糖尿病的多个治疗靶点。
二肽基肽酶IV抑制剂
鉴于DPP-IV是体内、外GIP和GLP-1的主要降解酶,故抑制DPP-IV可增强肠降血糖素的作用。为此,目前研发了一些DPP-IV抑制剂,可望用于2型糖尿病的治疗。
NVP-DPP-728(LAF-237)
本品由诺华公司开发,目前正在进行Ⅲ期临床研究,其疗效和安全性尚有待于进一步验证。
其他DPP-IV抑制剂
动物试验证实,异亮氨酸噻唑烷(isoleucine thiazolidide,P32/98)可快速抑制DPP-IV活性,延长GIP和GLP-1的t1/2,增加胰岛素分泌,使糖耐量恢复正常,血糖明显下降;另一种DPP-IV抑制剂——FE 999011,可使基础血浆GLP-1水平上升,GLP-1受体基因上调,在阻止糖耐量异常向2型糖尿病发展中有重要临床价值。
二、市场与发展前景
GLP-1是一种在胰岛素分泌和血糖调节方面有重要作用的肠道内分泌激素,能够促进胰岛素分泌、刺激胰岛β细胞增生、抑制胰升糖素分泌、延缓胃排空等作用,成为糖尿病治疗领域新的药物靶点。此外GLP-1(glucagons-likepeptide-1)还可从中枢神经系统控制食物的摄取,GLP-1已成为抗糖尿病药的新亮点。但由于GLP-1在体内极易被(DipeptidylpeptidaseIV)降解失活(这是GLP-1最大弱点,但是北京灵宝科技有限公司已经通过部分基团的修饰,将大大延长其在人体内的半衰期)。目前,多种GLP-1类似物在国外已经进入2型糖尿病的Ⅲ期临床试验阶段,有广阔的市场前景。其长期应用的远期疗效,以及是否会产生高胰岛素血症、肥胖等问题尚需进一步研究。目前在研究前沿的DDP-1抑制剂化合物有诺华制药公司的vildagliptin和美国默克制药公司的sitagliptin。二者都在争取及早上市,估计诺华制药公司将在2006年下半年向FDA递交申请,而默克制药公司将在2007年前递交申请,其实是在竞争首先上市,占领市场。在国内上海华谊集团公司下属的上海华谊生物技术有限公司自主研发的治疗2型糖尿病的 “谊生泰”(YST),日前获得国家食品药品监督管理局的临床批件,即将进入临床试验。另外国内在GLP-1方面有较成熟研究成果的是北京灵宝科技有限公司有限公司(北京灵宝科技有限公司),其在GLP-1 类似物工程菌构建工作有较大的突破。
关于人胰高血糖素样肽-1 的临床研究国内还处于起步阶段。其主要原因在于该产品还没有被广大制药企业认知。国内从事工程菌发酵生产多肽类药物的企业数量很少,加上其工程菌
开发难度较大,所以胰高血糖素样肽-1 是一个具有广阔市场前景,并且有一定技术壁垒的
高新技术产品。胰高血糖素样肽-1 必将成为即胰岛素之后的治疗2型糖尿病最有效和无毒附作用的有效生物药品。预计市场空间不低120亿美圆。
三、胰高血糖素样肽-1生产工艺技术介绍
方法1:多肽合成法。生产,虽然运用多肽合成方法生产的胰高血糖素样肽-1可以避免问题的困扰,但他的合成成本很高,生产周期长,产量不易扩大,给今后产品上市带来很多问题。
; 方法2:工程菌发酵法。 关于工程菌的两年以前就有国内科研机构申报,但是
没有被批准,所以国内不存在工程菌的问题。由于GLP-1在体内极易被(DipeptidylpeptidaseIV)降解失活,这是GLP-1最大弱点,所以国外同行都将其做部分结构的改变。GLP-1(1)可以促进胰岛素的分泌,(2)促进胰岛素生物合成的各个步骤,(3)降低已生成的胰高血糖素,(4)对无刺激胰岛素分泌无影响。LP-1系小肠促胰岛素H,促进餐间胰岛素分泌。GLP-1对2型糖尿病有明显效果,注射的GLP-1可被DPP-IV(二肽基肽酶)快速降解。所以使其药效大打折扣。
;Exendin-4是GLP-1的长效类似物,促进β细胞的新生和复制,使β细胞质量增加40%。它进入体内不会马上被破坏,它的倒数第二个N末端的氨基酸是甘氨酸,与GLP-1的倒数第二个是丙氨酸不同,因此它对DPP-IV有高度的耐受性。ADA去年报道它的效果很好。今年的ADA里还报道了NN2211,它也是GLP-1的长效类似物,但速度更快。北京灵宝科技有限公司现可以购建以上菌种(GLP-1原始序列;Exendin-4序列)。同时为了尽量避免有可能的国外方面的捆扰。北京灵宝科技有限公司现已经开发出新的GLP-1的长效类似物工程菌(SQ2005)。该菌珠在现有工程菌的基础上跟改部分氨基酸,第二个改进是对起整个分子连接一个特殊分子M,通过这两个方面的修改以达到GLP-1长效类似物对DPP-IV有高度的耐受性和提高其与胰岛β细胞细胞膜上的受体结合力。
新的工程菌有以下优点:
1.;构建基因工程菌的人胰高血糖素样肽-1的表达量高;
2.;用该基因工程菌生产人胰高血糖素样肽-1时,纯化步骤简便,得率高,生产成本低
北京灵宝科技有限公司已向国家局申请这一个新的。
四. 简单工艺描述
菌种类别
大肠杆菌工程菌株
技术数据
发酵类型 分批
发酵时间/hrs; 10
间歇时间/hrs; 12
周期/hrs;;;;; 24
发酵罐体积/L3 80
工作体积70%;; 50
发酵液体积/L3; 50
最终产物浓度mg/L;; 220mg/升
收率(盐酸盐) 30%
通气(VVM) 最大为 略
温度
PH
培养基
五、胰高血糖素样肽-1的经济效益
应用本技术每制造1g产品,制造成本:原材料+能耗=12000元/g。
表达量 220mg/升 发酵液,收率30%。
制剂: 30μg/支/120元
六、主要设备和建厂条件
公用工程包括蒸汽、电、水、冷却等。发酵设备属于通用设备,国产即可,部分设备进口。
纯化系统。
七、我们提供的服务内容
A、;人胰高血糖素样肽-1的技术咨询和转让
B、;引进人胰高血糖素样肽-1菌种和质粒、人胰高血糖素样肽-1菌种的发酵技术以及提取、纯化技术、工程设计。
C、;在一年提供有效的技术支持和培训。
八、转让费用和支付方式
;; 总共技术和菌种费用***万。
;; 递送资料前受让方给北京灵宝科技有限公司支付50%费用,在投产前受让方给北京灵宝科技有限公司支付30%费用。
;; 在投产三批产品后,达到合同生产能力,支付剩余20%款。
九.联系
如果需要详细的资料欢迎来人来函联系。
联系人:郑威项目经理
联系电话:010-56205725;53573251
联系传真:010-60511996
电子邮件:waley188@sohu.com